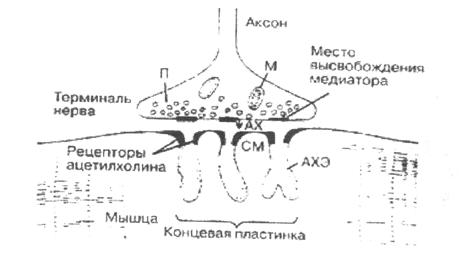
Часть II. ПАТОФИЗИОЛОГИЯ МИАСТЕНИИ (ИММУНО-БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ БЕЛКОВ ТИМУСА и IgG СЫВОРОТКИ КРОВИ) Миастения относится к синоптическим заболеваниям аутоиммунной, природы. На рис. 1 приведено схематическое изображение нервно-.мышечного соединения по Drachman D.B. (1978).
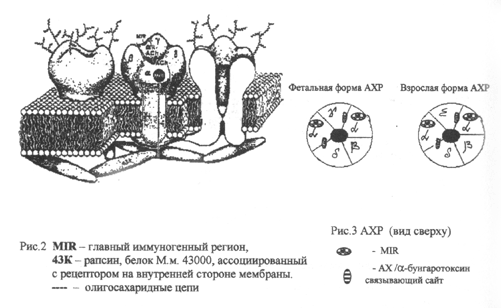
(Уткин Ю.Н. и др., 1999; Lindstrom J. 1997; Lena С, Changeux J.-P. 1998; Lindstrom J. et al., 1998; Cooper E.G., Jan L.Y. 1999). Существует ряд обзоров, посвященных структуре АХР (Уткин Ю.Н. и др., 1999; Hucho F. et al., 1996; Lindstrom J. 1996, 2000) и его роли при нервно-мышечных заболеваниях (Lena С., Changeux J.-Р. 1998; Lindstrom J. 1998; Cooper E.G., Jan L.Y. 1999 ). Последний такой обзор был опубликован J. Lindstrom в 2000 г. Модель трансмембранной организации АХР представлен на рис.2 (Lindstrom J. et al. 1983) и рисЗ. (Vincent A. 1998).
Наличие антител в сыворотке крови к некоторым нейрональным субъединицам, например к а7, аЗ выявлено у пациентов с болезнями Альцгеймера, Паркинсона, миастеническим синдромом Ламберта-Итона (Lindstrom J. 1996, 2000), а также миастенией и миастенией с тимомой (Li-Z. et al., 1997; Balestra В. et al., 2000). Снижение экспрессии al АХР в мозге наблюдается при шизофрении (Perl О., et al. 2001). Все субъединицы мышечного ацетилхолинового рецептора а-, р-, у- и 8- гликозилированы. В зависимости от стадии развития мышечный АХР имеет несколько вариантов: эмбриональный содержит у-субъединицу, которая у взрослых заменяется на е-субъединицу (Vincent A., 1988). Из данных литературы известно, что вырабатывающиеся при классической глазной форме миастении AT направлены не к al-, а к у-субъединице АХР, локализованной у взрослых людей только в экстраокулярных мышцах (Vincent А, 1991; OdaK, 1993). Согласно профилям гидрофобности аминокислотных последовательностей, все субъединицы АХР содержат четыре гидрофобных сегмента, которые пронизывают мембрану в виде а-спиралей. а-субъендиница рецептора состоит из экстрацеллюлярного N-концевого домена, за ним следуют три первые пронизывающие мембрану последовательности Ml, М2 и МЗ. Между МЗ и М4 располагается длинная (109-142 аминокислоты) соединяющая петля, которая выдается в цитоплазму и содержит все участки фосфорилирования рецептора. С помощью искусственного введения участков N-гликозилирования направленным мутагенезом было показано, что N-концевая последовательность а-субъединицы до остатка а-207, выступает с экстрацеллюлярной стороны мембраны. Использование поликлональных и моноклональных AT помогло выявить те участки полипептидов, которые ответственны за связывание АХ (или токсина), а также участки, формирующие собственно канал. На рис.4 представлено схематическое изображение <xl субъединицы ацетилхолинового рецептора. в участок 67-76 - главный иммуногенный регион (MIR), детектируемый с помощью mAB3S и др., • участок 58-59 - локализация дополнительной 25 аминокислотной вставки, • участок 371-378 - очень иммуногенный цитоплазматический эпитоп (VTCE-alpha), детектируемый с помощью тАЫ55. Для связывания с антителами большое значение имеют следующие аминокислоты: Lys373; Пе376; Glu377; Gly378 и Lys380. Образующиеся в организме больных миастенией AT относятся в основном к иммуноглобулинам класса G. AT против Н-холинорецепторов нарушают функцию нервно-мышечного синапса вследствии увеличения скорости деградации этих рецепторов, опосредованную эндосомами и лизосомами (dementi F. et al.,1982, Higuchi H.K.et al.,1982). Патогенетическую роль AT доказывает развитие экспериментальной аутоиммунной миастении (EAMG) у животных, иммунизированных сывороткой крови и лимфоцитами больных миастенией (Wang Z. et al., 2000). При этом происходит сенсибилизация CD4+ клеток и появление в крови подопытных животных высокоаффинных IgG антител, реагирующих с мышечными АХР (Bellone M. et al., 1993; Karachunski P.I. et al., 2000).” Кроме этого IgG антитела, проникая через плаценту, способны вызвать миастению у новорожденных. Vincent A. et al., (1998) сообщает о случаях артрогриппоза плода у женщины не страдающей миастенией, но имеющей высокий уровень антител в сыворотке крови к фатальным АХР. Поскольку каждое аутоиммунное заболевание имеет свой спектр аутоантител, то их идентификация имеет большое значение в постановке диагноза, оценке прогноза и выборе тактики лечения. В этом смысле аутоАТ являются маркерами аутоиммунных заболеваний и их обнаружение может указывать на три возможности: аутоАТ служат1 причиной патологического процесса, аутоАТ образуются вследствие повреждения тканей, вызванного тем или иным патологическим процессом, и существует некий третий фактор, который лежит в основе и повреждения ткани, и появления аутоАТ (Роит А., 1991). Существующие методы количественного определения антител имеют как преимущества, так и недостатки. В применяющихся ИФА наборах (Gotti С. et al., 1997, Franciotta D. et al., 1999) в качестве антигена используется рабдомиосаркомная клеточная линия ТЕ 671, экспрессирующая АХР, что имеет технические сложности получения и работы с такими препаратами. В радиоиммунологическом методе неудобство заключается в необходимости применения препарата [125 I] меченного а - бунгаротоксина (Vincent A., Newsom-Davis. 1985; Nguyen Vu.K. etal., 1999 и др.). В 1999 году Nguyen Vu. К. et al. провели отдельную работу, посвященную сравнению этих методов. В ней авторы сравнивали антигенную специфичность АХР, выделенных из различных источников, оценивали чувствительность методов, достоверность и корреляцию полученных двумя методами данных. ИФА представляет собой гетерогенную систему, в которой АГ иммобилизуется на твердофазный носитель, вследствии чего могут возникать различные конформационные изменения, ухудшающие конечный результат. Для преодоления этого авторами был предложен стабилизатор. РИА протекает в гомогенной среде и факторы влияющие на этот процесс другие. Естественно, что радиоиммунологический метод на порядок более чувствителен и позволяет определить даже невысокую концентрацию антител в сыворотке крови. Однако ИФА более удобен, поскольку не требует дорогостоящего оборудования и средств индивидуальной защиты, наборы для ИФА могут гораздо дольше храниться и метод является практически безопасным. Нами показана возможность использования экстрацеллюлярного домена мышечного АХР, полученного с помощью гетерологической экспрессии соответствующего фрагмента кДНК в Е. Coli, для количественного определения аутоантител в сыворотке крови больных миастенией методом ИФА (Ланцова В.Б. и др., 2001; Сепп Е.К.и др. 2002). Две формы а 1-субъединицы экстрацеллюлярного мышечного АХР человека (HR и НЕ), использовавшиеся в ИФА, были предоставлены лабораторией рецепции нейропептидов ИБХ РАН (зав. лабораторией, проф. В.И. Цетлин). Конструкция HR содержала дополнительный 25 аминокислотных фрагмент, расположенных между 58-м и 59-м аминокислотными остатками, которого нет в конструкции НЕ. Очистку и рефолдинг экспрессированных белков проводили двумя способами: по оригинальной методике лаборатории HR(1) и НЕ(1) и белки HR(2) и НЕ(2) - по модифицированной методике, предложенной Tzartos S.J. et. al. (2000). По взаимодействию с конформационно-зависимыми моноклональными антителами (шАЬЗЗ) для проведения дальнейшего исследования был выбран белок HR2. Обследовано 132 больных миастенией, 30 - в динамике. Перечисленными выше методами можно определить общую концентрацию аутоантител в сыворотке крови. Это позволяет с вероятностью до 80% подтвердить диагноз миастении, но не дает возможности провести корреляцию между количеством обнаруженных AT и тяжестью состояния, особенностями распределения мышечной слабости, а также характером течения патологического процесса (Сиднев Д.В. и др., 2002, Karachunski P. et al., 1999). Это может быть связано с различиями в свойствах AT. К настоящему времени установлено (Bellone M. et al., 1993), что существуют две субпопуляции Th-клеток CD4+ (ТЫ и Th2), различающихся по профилю синтезируемых ими цитокинов. ТЫ цитокины стимулируют образование в сыворотке крови анти-АХР-аутоантител, фиксирующих комплемент в мышечном синапсе и обладающих высоким патогенетическим потенциалом вследствие комплемент-опосредованного лизиса антиген-антительных комплексов, которые были выявлены путем электронной микроскопии в экспериментальных работах на животных, проводимых в Минессотском университете в 1999-2001 годах. Переключение иммунного ответа в сторону преобладания ТЬ2-типа, характеризуется тем, что цитокины, продуцируемые этими клетками, стимулируют синтез IgA, IgE, IgG4 антител, не фиксирующих комплемент и не приводящих к повреждению АХР. AT, вырабатываемые при обоих типах иммуного ответа имеют общий антигенсвязывающий участок (Fab - фрагмент), но отличаются Fc-фрагментом, связывающим комплемент.
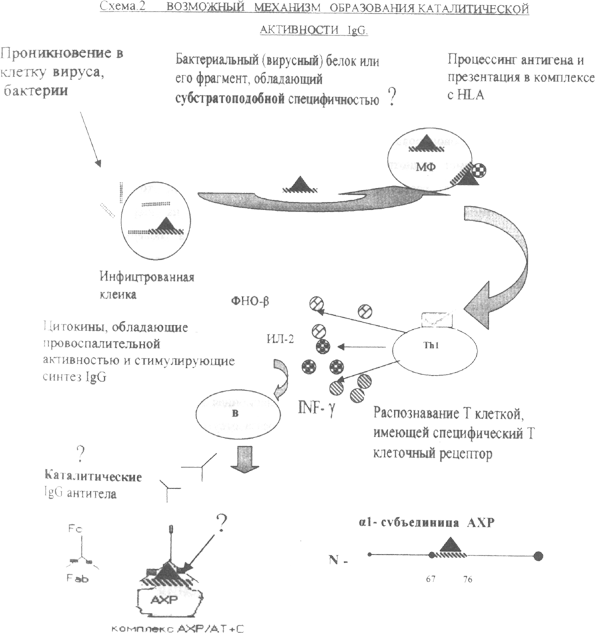
Завалишин И.А. и соавт. (2000) связывают гетерогенность пула антител сыворотки крови при рассеянном склерозе с неспецифической гиперактивностью В-клеток, вызванной нарушением иммунной регуляции, например, дисбалансом соответствующих цитокинов. Этот факт дает основание сделать предположение о неспецифичности иммунологических механизмов при аутоиммунных заболеваниях. При этом поражаемые антигенные мишени различны при разных заболеваниях. Для миастении это АХР постсинаптической мембраны, белки мышечной ткани, рианодиновые рецепторы, для рассеянного склероза - миелин и олигодендроглия, для системных болезней соединительной ткани -структуры соединительной ткани. Способность организма к развитию иммунного ответа против определенного аутоантигена генетически детерминирована Существенно повышается риск развития конкретного заболевания при наличии характерного для данного патологического процесса типа HLA ассоциации. Многие исследователи сообщают о клинической неоднородности, большом полиморфизме и разбросе данных в отношении показателей иммунитета и при миастении, и при рассеянном склерозе. С одной стороны, возможно, что одним из факторов, определяющих разнообразие клинических проявлений и течения этих заболеваний является различие антигенных мишеней на разных стадиях болезни (Завалишин И.А. и др., 2000). С другой стороны, клинический полиморфизм может быть связан с различиями в каталитической активности IgG антител. Многообразие клинических проявлений, неоднозначность и субъективность оценки отдельных симптомов миастении, отсутствие корреляций между тяжестью проявления заболевания и электрофизиологическими феноменами (Vincent A., Newsom-Davis J. 1985; Wang Z.-Yu. et al., 2000), а также наличие сопутствующей патологии, влияющей на синаптическии и аутоиммунный процесс делает насущной проблему поиска новых дополнительных методов диагностики и контроля за эффективностью лечения миастении. В последнее время интенсивно изучается новая функция антител и иммуноглобулинов - их способность ускорять различные биохимические превращения (Генералов И.И. и др., 1998; Kulberg A.Ya. 1999; Габибов А.Г. 2000; Сидорская Е.В. и др., 2000; Генералов И.И. 2002; Paul S. 1996). Выяснилось, что в определенных условиях иммуноглобулины могут выступать в роли биологических катализаторов - абзимов (antibody + enzyme), а проявляемая ими активность была названа абзимной. Известно, что AT устроены одинаково - из довольно консервативного "каркаса" и нескольких гипервариабельных участков, благодаря которым осуществляется связывание. Наличие каталитической активности у AT некоторые авторы (Paul S., 1996) связывают с аминокислотными заменами, которые могут изменять свойства AT, например способность их связывания с антигеном. Фаворова О.О. (2002) считает, что исследование уровня активности в сыворотке крови больных рассеянным склерозом каталитических антител, специфически гидролизующих ДНК, РНК и основной белок миелина, может являться принципиально новым диагностическим признаком, позволяющим оценить глубину патологического процесса. До настоящего времени абзимная активность IgG при миастении не изучалась. Вместе с тем, уникальность каждого организма связана с особенностями функционирования ферментативных систем и, возможно, что индивидуальные особенности проявлений миастении (характер течения заболевания, распределения мышечной слабости, реакция на различные виды лечения и др.) могут быть связаны с каталитической активностью специфических AT. Предполагается, что появление AT, обладающих различной каталитической активностью, в организме при миастении указывает, с одной стороны, на наличие аутоиммунного заболевания (диагностическая значимость), а с другой - может проливать свет на их роль как специфического агента, который модифицирует метаболические процессы, протекающие в синапсе. В последнем обзоре Генералов И.И. (2002) обращает внимание на то, что в первую очередь требуют анализа генетические факторы, обусловливающие появление поликлональных IgG антител, обладающих абзимной активностью. Для некоторых абзимов экспериментально показано, что каталитическая функция может определяться как генами зародышевых линий, так и возникать вследствии соматических мутаций после контакта с АГ. Габибов А.Г. (2000) считает, что именно в случае изучения AT очень важно понять функцию каждой аминокислоты в участках связывания, т.к., с одной стороны, морфология генов идентична, а с другой - единичная замена может существенно изменять свойства AT. Paul S. (1996) указывает, что принципиальное значение это приобретает в случае каталитических AT, когда в результате нескольких замен AT приобретают не только новые характеристики связывания, но и возможность ускорять те или иные процессы. Очень важно выявление локализации каталитических центров. Например в своих исследованиях Генералов И.И. и др., (1998) продемонстрировали, что центры пероксидазной абзимной активности находятся в Fc-фрагменте молекулы IgG, так как блокада свободным протеином А, который связывается с молекулой IgG в области СН2- домена, полностью ингибировала пероксидазную реакцию. Возможно, что исследование пероксидазной абзимной активности IgG больных миастенией помогло бы выявить аугоантитела, обладающие высоким патогенетическим потенциалом. Paul S. et al., (1989) исследовали способность иммуноглобулинов больных бронхиальной астмой гидролизовагь вазоактивный интестинальный полипептид, обладающий разнообразными регуляторными эффектами. Вазоактивный интестинальный полипептид (м..в. 3325,9) взаимодействует с кальмодулином, мишенями которого как вторичного посредника служат до 30 различных клеточных систем, включая синтазы окиси азота, мембранные кальциевые насосы и т.п. Активность сохранялась в препаратах Fab-фрагментов AT. В обзоре Генералова И.И. (2002) цитируются интересные работы по компьютерному моделированию каталитических параметров поликлональных абзимных AT и изучению характеристик суммарного пула различных по активности катализаторов (Stephens D.B. et al., 1993; 1994). Моделировалось нормальное распределение характеристик пула и скошенное распределение Вейбулла, которое отражает преобладание в пуле молекул с более высоким сродством к АГ. Такое явление наблюдается in vivo, когда происходит преимущественная селекция клонов, высокоаффинных к АГ. Проводимые нами исследования (Ланцова В.Б., Сепп Е.К.,2002) позволили установить, что ходе поликлонального аутоиммунного ответа в сыворотке крови больных миастенией появляются иммуноглобулины, обладающие каталитической активностью, которая, вероятно, связана либо с появлением у них аминокислотных последовательностей, характерных для каталитических центров ферментов, либо с конформационно- ' подобными феноменами. С целью выявления возможной ферментативной ; функции специфических анти-АХР AT было проведено исследование;! трансаминазной, транспептидазной, фосфатазной и креатинкиназной г активности конформационно-зависимых моноклональных AT (тАЬЗЗ) и. поликлональных IgG (pQ 1-209), полученных в процессе иммунизации животных экстрацеллюлярным фрагментом АХР, а также IgG сыворотки крови больных генералюованной, глазной формами миастении и при миастении, ассоциированной с тимомой. Самой высокой фосфатазной (до 63 Ед/мг) и креатинфосфокиназной (61 ЕД/мг) активностью обладали AT pQ 1-209. Подобная активность практически отсутствовала у mAb35 AT и нормальных кроличьих IgG. Однако mAb35 AT обладали в основном у-ГТП активностью, которая составила 10,5 Ед/мг. В группе больных миастенией с тимомой выявлена креатинфосфокиназная активность IgG (9,2 Ед/л), которая была в 2 раза выше по сравнению с контролем и в 1,5 раза - по сравнению с неопухолевой миастенией. Активность же остальных ферментов была примерно одинакова и статистически не различалась по группам. Наиболее интересен тот факт, что моноклональным конформационно-зависимым антителам тАЬ35, связывающимся с высоким сродством с АХР (Tsouloufis Th et al, 2000), присуща каталитическая активность. Такое проявление биологической активности может рассматриваться как дополнительная иммунобиохимическая характеристика этих антител. Генералов И.И. и соавт. (1998) считают, что появление белковых соединений, обладающих иммунологической и ферментативной активностью, может существенно изменять метаболизм органов и тканей организма, вовлеченных в патологический процесс. Возможно, этим механизмом объясняется полиморфизм клинических проявлений ряда аутоиммунных заболеваний, в том числе и миастении. Обладая повышенной фосфатазной активностью, IgG антитела могут изменять биологическую активность фосфорилированных белков, к которым относится АХР. Возможно, что, изменяя конформацию рецептора, они делают его более доступным для атаки специфическими AT с привлечением белков системы комплемента, либо изменение конформации приводит к нарушению связывания с лигандом (например -ацетилхолином), что влечет за собой нарушение нервно-мышечной передачи. Динамическое изучение у-ГТП активности AT вероятно сможет объяснить появление у больных резистентности к иммуносупрессии, так как это - фермент, участвующий в обмене глутатиона, который, в свою очередь, осуществляет детоксикацию лекарственных препаратов, являясь ангиоксидантом. Возможно IgG антитела больных миастенией, обладая КФК активностью, принимают участие в увеличении концентрации АТФ, тем самым частично компенсируя нарушение метаболизма в мышце. Но с другой стороны, возможно, КФК активность необходима просто для энергетического обеспечения патологического процесса. Полученные нами данные (повышение КФК активности IgG преимущественно у больных с тимомой) косвенно свидетельствуют о вовлечении в патологический процесс не только синапса, но и мышечного субстрата при данном виде патологии.
Завалишин И. А. и соавт. (2000) приводят данные о наличии 129 вирусных и бактериальных пептидов, сходных со структурой участка 85-99 основного белка миелина Вполне возможно, что внешний агент (вирус или паразит), вызвав образование антител, несущих общий перекрестно реагирующий с рецепторами аутореактивных Т- и В- клеток идиотип, способен провоцировать аутоиммунный ответ. Если закодированные в геноме гамет идиотипы аутоантител генерируют целый спектр антиидиотипов, реагирующих с экзогенными антигенами, то можно предполагать, что антитела, образующиеся в ответ на инфекцию, взаимодействуют с соответствующим идиотипом на поверхности аутореактивного лимфоцита. Например, одна из гибридом, полученная из лимфоцитов больного миастенией, секретировала антиидиотип к аутоантителам против АХР. Эти антиидиотипы, как обнаружилось, реагируют с 1,3-декстраном, представляющим собой продукт бактериальной природы (Роит А., 1991). Подобный механизм исследован в работе Конорева М.Р. и соавт. (2000) у пациентов, инфицированных Helicobacter pylori. Была выявлена корреляционная зависимость между уровнем уреазной активности (в норме уреаза отсутствует в организме человека, но вырабатывется в Helicobacter pylori) у поликлональных IgG антител, выделенных из сывороток пациентов, и их количеством. Cреди аутоиммунных болезней миастения занимает особое место, так как механизмы ее развития неизмеримо более интимно связаны с тнмусом (вилочковой железой), чем другие аутоиммунные заболевания (Харченко В.П. и др., 1998). Патологические изменения тимуса встречаются у 60% больных миастенией (Кузин М.И, Гехт Б.М, 1996; Vincent А, 1988). Ни при одном другом аутоиммунном заболевании удаление вилочковой железы не дает такого высокого процента положительных результатов (улучшение или выздоровление), как при миастении (от 60 до 80% по данным Харченко В.П. и др.,1997; Лайсек Р.П., Барчи Р.Л, 1984; Berrih-Aknin S. et al., 1987; Drachman D, 1987; Lisak R, 1990). В основе аутоиммунного процесса при миастении может лежать дисфункция вилочковой железы (Kaminski H.J. et al., 1993; Hohlfeld R, Wekerle H. 1994; Кузин М.И., Гехт Б.М. 1996), которая, являясь одним из центральных органов иммунной системы, контролирует механизмы иммунорегуляции (центральная тимическая толерантность), обеспечивает продукцию и функционирование различных субпопуляций Т-лимфоцитов. Полноценное представление о миастении как органоспецифическом аутоиммунном заболевании невозможно без исследования вилочковой железы. Патология вилочковой железы наблюдается более чем у 60% пациентов Vincent А. (1988). Ряд авторов (Compston D.A.S. et al., 1980; Харченко В.П. и др., 1998) разделяет больных миастенией по виду патологии тимуса (тимома, гиперплазия, атрофия), возрасту начала заболевания и HLA ассоциации. Примерно в 9-16 % наблюдений генерализованная миастения сочетается с тимомами - наиболее часто встречающимися новообразованиями переднего средостения (Eymard В., Berrih-Aknin S. 1995; Кузин М.И., Б.МГехт. 1996). Гиперплазия вилочковой железы чаще встречается у женщин моложе 40 лет и эффективность тимэктомии в этой группа больных может достигать по данным некоторых авторов 100% (Харченко В.П. и др., 1998; Lisak R., 1990). Для пациентов этой группы характерно повышение IgG, в меньшей степени IgA, узкий спектр при высоком титре антител (в 80-90% это антитела к АХР, а у 50% пациентов и к другим антигенам), HLA ассоциация В8, DR3, преобладание поражения 1, 3 и 4 региона АХР (Compston D.A.S.et al., 1980; Tzartos S.J. et al., 1982; Vicira ML., et al., 1993). При атрофии тимуса иммуногистохимическое исследование показывает резкое уменьшение продукции химических гормонов, достоверное снижение активности Т-супрессоров и уменьшение продукции иммуноглобулинов А и G. Характерна HLA ассоциация А2, В7, DR2, при невысоком титре антител к АХР с поражением 1 и 4 его регионов (Compston D.A.S. et al., 1980). Атрофия тимуса встречается преимущественно у пациентов мужского пола старше 40 лет и тимэктомия неэффективна в 58% случаев (Харченко В.П. и др., 1998). Тимомы по клеточному составу подразделяются на доброкачественные и злокачественные. При этом органоспецифическими (Харченко В.П. и др., 1998) считают те тимомы, гистогенез которых связан с эпителиальным компонентом. Marx A. et al. (1993) выявили наличие РЗА экзона, кодирующего дополнительный 25 аминокислотный фрагмент, располагающийся между 58 и 59 аминокислотными остатками экстрацеллюлярного фрагмента альфа субъединицы АХР, что может иметь значение для патогенеза паранеопластической миастении. Не существует определенной HLA ассоциации у больных миастенией при наличии тимомы (Compston D.A.S. et al., 1980). AT в крови больных с тимомой, с миастенией и без нее, имеют широкий спектр и представлены AT к различным структурам мышечной ткани (Janossy G. et al., 1986; Drachman D. 1987; Vicira M.L. et al., 1993). Так, специфичным считается тест на антитела к лимоннокислому экстракту мышц (Drachman D., 1987) и титин-белку (Aarli J. et al., 1998, Санадзе А.Г. и др., 2002) у больных с тимомами. Возраст начала заболевания в этой группе колеблется преимущественно от 30 до 60 лет. Эффективность оперативного лечения у больных миастенией с тимомами оценивается по двум параметрам: наличие или отсутствие рецидивов опухоли и характер течения миастенического процесса после тимомтимэктомии. Гиперплазированный тимус содержит зародышевые центры, обуженные интердигитальными клетками с клеточными АХР. При тимомах миастеногенный аутоантиген менее изучен. Эпителий тимомы экспрессирует белки, подобные некоторым участкам АХР, которые не имеют с ним полного молекулярного сходства Это уникальный тип молекулярной мимикрии может инициировать тимомзависимый вариант миастении.
Среди различных белков, участвующих в аутоиммунном процессе при миастении и локализованных в тимусе, идентифицированы никотиновые ацетилхолиновые рецепторы (Kaminski H.J. et al., 1993), клеточные рецепторы для антител FcyRI (CD64), FcyRTI (CD32), FcyRIII (CD 16) (Raknes G. et al., 1998), белки, принадлежащие к семейству онкогенов (Gilhus N.E. et al., 1995) и адгезинов (Hafer-Macko С. et al., 1996), Fas антигены и их лиганды (Kawanami S. et al., 1999, 2000), нейроэндокринные маркеры (Marie J. et al., 1999; Zoltowska A. et al., 1998) a также titin белки (Berrih-Aknin S. et al., 1987) и рианодиновые рецепторы (RyR) скелетных мышц (Mygland A. et al., 1994). Первые из них (АХР) являются молекулами - мишенями для AT сыворотки крови, поддерживающих аутоиммунную агрессию при миастении, антионкогены и Fas антигены способны ингибировать или активировать запрограмированную гибель клеток (апоптоз), что приближает к пониманию механизмов клеточного роста Роль рианодиновых рецепторов в качестве антигенных структур в настоящее время интенсивно исследуется и уже сейчас появились работы (Mygland A. et al., 1994, 1995), в которых сообщается о том, что образующиеся в организме больных с тимомзависимым вариантом миастении антитела к RyR являются причиной мышечной слабости. Вероятно, эти антигенные белковые молекулы могут оказаться мишенями, характерными для миастении ассоциированной с тимомой, а специфические антиКуК AT - маркерами этой формы аутоиммунной патологии. Клеточные рецепторы для IgG опосредуют ряд эффекторных функций антител. IgG, связываясь с Fey рецепторами, инициируют ту или иную биологическую активность клетки, например, такую как зависимая от антител клеточная цитотоксичность, высвобождение медиаторов и презентация антигена. Известно три типа Fey рецепторов, которые встречаются в 12 различных изоформах, и, кроме того, исследован генетический полиморфизм генов FcyRIIA-H/H и FcyRIIA рецепторов для IgG при миастении. Интересно, что, во-первых рецепторы по-разному связывались с IgG, во-вторых это связывание никак не соотносилось с уровнями антител ни к АХР, ни к титин-белкам, ни к RyR. Выяснилось, что при тимомах ассоциированных с миастенией, чаще встречается генотип FcyRIIA-H/H. Недавно группой исследователей (Raknes G. et al., 1998) методом полимеразной цепной реакции было проведено изучение полиморфизма генов рецепторов FcyRIIA и FcyRIIIB с различной способностью связывания IgG Было установлено, что генотип FcyRIIA- H/H встречался чаще при тимомах у миастенических пациентов. Однако ( уровни антител к АХР, титин-белкам и RyR не были связанны с FcyRIIA ;или FcyKHIB генотипами. Результаты предполагают различные патогенетические механизмы в развитии паранеопластической и непаранеопластической миастении. На начальных этапах изучения роли вилочковой железы при миастении в культуре тимусной ткани больных были обнаружены клетки/* несущие рецепторы к ацетилхолину (АХ), которые являются первичными ; АГ, индуцирующими аутоиммунную реакцию против мышечных АХР (Eymard В., Berrih-Aknin S., 1995). Далее, Nagvekar N. et al. (1998) установили, что эпителиальноклеточные опухоли тимуса, ассоциированные c миастенией, экспрессируют эпитоп цитоплазматический части АХР а 373-380 (VICE-alpha). Tzartos S. et al. (1999) обнаружили антитела в сыворотке крови к этим участкам а субъединицы (354-360 и 373-380) у части больных миастенией. Предполагалось, что сенсибилизация к этому эпитопу являлась пусковой для аутоиммунной реакции против АХР у пациентов с тимомзависимой миастенией. Применяя иммуногистохимические методы, Kawanami S. et al. (1999) установили локализацию Fas антигена и АХР в эпителиальных клетках телец Гассаля и подкапсуллярных эпителиальных клетках тимуса больных миастенией и в тимомах. Продолжая начатые исследования (Kawanami S. et al., 2000), авторы выделили АХР и Fas антиген из экстракта кортикальной тимомы больных миастенией. В неопластических эпителиальных клетках тимуса методом иммуноблотгинга были определены оба антигена. Бьша установлена гомология аминокислотной последовательности АХР и Fas антигена в следующих участках: а 316-355 9 Fas 232-271, у 321-352 9 Fas 3-34. Ha основании этих исследований авторы полагают, что эти два антигена могут играть пусковую роль в возникновении аутоиммунной реакции против АХР. Нами проведено исследование (Ланцова В.Б., Сепп Е.К. 1999; 2002) антигенных белков тимуса (при его гиперплазии, атрофии и опухолевой трансформации) с помощью поликлональных антител к коротким пептидам, которые аналогичны некоторым участкам нейрональных субъединиц АХР: <х4 (375-404) и а7(7-30), а7(322-338), 02(34-50), а также al (1-209) субъединицы мышечного нАХР. При иммуноблоттинговом исследовании только в белковой смеси, выделенной из ткани тимомы, идентифицированы три окрашенных белковых полосы с м.в. 14, 12 и 10 кДа, которые связывают антитела к цитоплазматическому участку а4 субъединицы нейронального нАХР, что может быть отражением многообразия антигенных структур опухолевого тимуса Рианодиновый рецептор. Сравнительно недавно были открыты другие антигенные молекулы, к которым относятся RyR кальций высвобождающих каналов саркоплазматического ретикулума. Эти рецепторы относятся к хемовозбудимым каналам, лигандом которых является кофеин. Появление у больных миастенией с тимомой AT к RyR рассматривается рядом авторов как признак злокачественного течения миастенического процесса (Mygland A. et al., 1994; Kusner L.L. et aL, 1998). В работах последних лет имеются сведения об обнаружении у больных миастенией в сочетании с тимомой AT к RyR скелетных мышц (Kusner L.L. et al. 1998), титр которых коррелирует с проявлениями болезни и смертностью. Уровень RyR антител положительно коррелировал с тяжестью миастенического процесса (Skeie G.O. et al., 1998). Рианодиновые рецепторы кальциевых каналов участвуют в механизме сокращения поперечно-полосатой мышцы. В работе Mygland A. et al. (1995) тимома была исследована с панелью поликлональных кроличьих антител против различных коротких пептидов RyR. AT связывались с пептидом С2 трансмембранного участка RyR, присутствовавшего в тимомных эпителиальных клетках. При этом С2 RyR AT не взаимодействовали с нормальным тимусом, миндалинами и карциномой толстой кишки. Экспериментальным изучением рианодиновых рецепторов у крыс линии Buffalo со спонтанно возникающими тимомами занимались Iwasa К., et al. (1998), которые подтверждают, что причиной мышечной слабости в эксперименте являются анти-RyR AT. Интересно отметить, что AT к АХР в сыворотке крови животных отсутствовали, поэтому мышечная слабость обусловлена именно анти-RyR антителами. Антионкогены. Наиболее интересные результаты получены при исследовании экспрессии генов, способных ингибировать или активировать запрограммированную гибель клеток, например, bcl-2, c-mys, р53 гены, а также гены комплекса Раз-лиганд/Раз антиген, которые принимают участие в регуляции клеточного роста. Установлено, что bcl-2 (белок Мм. 25-26 кД) действует как антиоксидант, ингибируя развитие апоптоза, вызванного перекисью водорода или истощением запасов глутатиона (Fawthrop D.J. et al., 1991). Недостаточная информативность морфологических критериев диагностики инвазивных, неинвазивных и злокачественных тимом привела к поиску других методов их дифференцировки, основанных на идентификации факторов, действующих как супрессоры клеточной пролиферации. Эти факторы могут контролировать рост нормальных клеток и участвовать в процессе клеточной трансформации. В работе Chen F.F. et al. (1996) иммуногистохимическим методом была исследована экспрессия белков bcl-2 и р53 эпителиальными клетками тимуса. Высокая экспрессия белка bcl-2 наблюдалась при карциномах тимуса и при тимомах в сочетании с миастенией. Появление в клетках белка р53 не коррелировало с гистологическим типом и тяжестью миастенического процесса, тогда как обнаружение в клетках вилочковой железы bcl-2 свидетельствовало об агрессивности тимических эпителиальных опухолей. В то же время Onodera J. et al. (1996), изучая экспрессию Fas антигена и bcl-2 протеина в гиперплазированном и опухолевом тимусе, обнаружили, что Fas антиген локализуется главным образом в эпителиальных клетках медулярной части тимуса, в то время как bcl-2 протеин часто экспрессирован в медуллярных тимоцитах при гиперплазии и редко в тимомах. Авторы предполагают, что bcl-2 протеин можно рассматривать как регулятор процессов роста, происходящих в тимусе при миастении, через механизм апоптоза аутореактивных тимоцитов. Неспецифичные по отношению к иммунному ответу белки. Кроме этих белковых антигенных молекул, имеющих большое значение, при миастении были определены и другие белки. Считается, что они неспецифичны по отношению к иммунному ответу, хотя помогают его формированию, организуя миграцию клеток или усиливая межклеточные контакты в процессе распознавания антигена. Молекулы клеточной адгезии - связанные с плазматической мембраной белки - обеспечивают механическое взаимодействие клеток друг с другом. Изучение этих белков при тимомах имеет огромное значение, так как изменение количества этих молекул связывают с метастазированием, а повышение плотности адгезивных молекул индуцирует внутриклеточные метаболические реакции. Коллектин-1 относится к семейству калыщйзависимых лектинов (коллагеновых лектинов). Он синтезируется эпителиальными клетками в миастеническом тимусе при его гиперлазии и опухолевом перерождении, а также в тимусе детей. Этот белок играет роль в межклеточных взаимодействиях при миастении (Hafer-Macko С. et al., 1996). Относимые к классу молекул клеточной адгезии Е - кадгерин (E-CD), а также а- и 0-катенины были обнаружены в кортикальноклеточных тимомах. В смешанноклеточных и медуллярных тимомах эти белки не выявлялись. Кроме этого было установлено, что наличие этих молекул ассоциировано с гистологическим субтипом тимом, но экспрессия этих молекул не коррелирует с инвазивностью и началом миастении (Pan С.С. et al., 1998). Дальнейшие исследования, направленные на изучение вопросов, связанных с выяснением роли нейроэндокринных маркеров, были продолжены группой ученых (Marie J. et al., 1999), которые обнаружили в эпителиальных клетках человеческого тимуса и тимомах при миастении рецепторы для штестшального вазоактивного пептида, кальцитонина, кальцитонш-генсвязанного пептида. В результате этой работы было установленно, что эти соединения могут играть важную роль в течении и озлокачествлении тимом. Известно, что уменьшение экспрессии АХР возможно связано с нарушением модулирующего влияния кальцитонин- генсвязанного пептида. Этот пептид регулирует синтез постсинапитических АХР, увеличивает действие ацетилхолина и оказывает прямой эффект на сократительные белки поперечно-полосатых мышц. До настоящего времени практически не изучен вопрос о механизме возможного участия системы гамма - глутамштранспептидазы (у-ГТП) в иммунологических реакциях. Универсальная роль у-ГТП в таких ключевых процессах поддержания гомеостаза, как обмен глутатиона и аминокислот, не исключает функциональной органоспецифичности фермента. Предполагается, что локализованная в лимфоцитах у-ГТП может обуславливать их поверхностные иммунологические свойства (Чернобровкина Т.В., 1992). Имеются сообщения об обнаружении фермента на поверхности Т- и В-лимфоцитов периферической крови, причем в норме активность у-ГТП преобладает в субфракции В-клеток (Novogrodsky A. et al., 1976). Нами было показано (Ланцова В.Б., Сепп Е.К.,2000), что наиболее значимое изменение активности у - ГТП наблюдается у больных с тимомами, которая была повышена в опухолевой ткани в 56,5 раз, а в окружающей - в 10,6 раза Полученные результаты согласуются с данными других авторов, предполагающих, что тимомы в процессе роста интенсивно используют глутатион (Короткина Р.Н. и др., 1999). Кроме этого, будучи сиалогликопротеинами по природе, субъединицы у-ГТП в определенных условиях, вероятно, могут образовывать комплексы с белками или их фрагментами и служить собственно антигенами или способствовать антигенообразованию. Подытоживая вышеизложенное, можно предположить причастность ферментной системы у-ГТП к регуляции иммунологической реактивности организма при миастении. Так, являясь гликопротеидом, фермент, локализованный с субпопуляциях Т- и В-лимфоцитов, может выполнять роль иммуномодулятора на клеточном уровне. В частности, сиаловый компонент молекулы у-ГТП на поверхности Т-хелперов и Т-киллеров может обеспечивать процесс “узнавания” антигенов и определять мощность киллерной активности и продуктивность антителообразования. Таким образом, несмотря на продолжительность и масштабность изучения антигенных белков тимуса и большой фактический материал, вопросы происхождения, биологической роли и механизма их действия по-прежнему остаются нераскрытыми. |
||||||||
14.11.03